Depuis juin 2015, nos organisations travaillent avec les communautés de l'hypertension artérielle pulmonaire (HTAP) et de la sclérodermie pour plaider en faveur d'un accès financé par l'État à tous les traitements de l'HTAP approuvés par Santé Canada, y compris Opsumit, Adempas et Uptravi. Nous continuons d'être préoccupés par les disparités qui existent dans la qualité des soins que les patients atteints d'HTAP peuvent recevoir selon la province dans laquelle ils vivent ou s'ils ont une assurance privée.
Opsumit® (macitentan)
Approbation :
En novembre 2013, Santé Canada a approuvé la vente d'Opsumit au Canada pour le traitement de l'HTAP. Opsumit, un antagoniste des récepteurs de l'endothéline (ERA), est approuvé pour le traitement des patients atteints d'HTAP idiopathique (HTAP sans cause connue), d'HTAP héréditaire, d'HTAP associée à des troubles du tissu conjonctif et d'HTAP associée à une cardiopathie congénitale. Opsumit est actuellement le seul traitement oral prouvé dans un essai contrôlé randomisé pour réduire la morbidité à long terme chez les patients, y compris la réduction de l'aggravation de l'HTAP et des hospitalisations.
Financement public :
En octobre 2014, le Québec a commencé à fournir un remboursement public pour Opsumit. En janvier 2015, le Common Drug Review (CDR) national a recommandé qu'Opsumit soit financé par l'État (avec des critères et une condition) pour le traitement à long terme de l'HTAP afin de réduire la morbidité chez les patients de classe fonctionnelle II ou III. Cependant, à la fin de 2015, les négociations sur les prix d'Opsumit par l'intermédiaire de l'Alliance pharmaceutique pancanadienne (APC) ont été clôturées. Par conséquent, les patients atteints d'HTAP à l'extérieur du Québec qui pourraient bénéficier d'Opsumit, y compris ceux touchés par la SSc-HTAP, n'ont pas pu y accéder grâce au financement public.
En juillet 2019, pCPA a rouvert les négociations pour Opsumit, et le 23 décembre 2020, une lettre d'intention (LI) a été signée. La dernière étape du processus de remboursement consiste, pour chaque province, à signer une entente de liste de produits (ELP) avec le fabricant d'Opsumit afin de rendre le traitement accessible aux patients qui peuvent en bénéficier.
Depuis le 1er février 2023, Opsumit est devenu accessible grâce à un financement public dans toutes les provinces sauf la Colombie-Britannique.
Statut de défense de la cause :
En février 2021, l'AHTP Canada a contacté tous les ministres provinciaux de la Santé et des Programmes publics de médicaments à travers le pays pour les exhorter à fournir un remboursement rapide d'Opsumit aux patients atteints d'HTAP. En mars 2021, l'AHTP Canada a lancé une campagne de réunions virtuelles avec des représentants élus provinciaux à travers le pays pour demander qu'Opsumit soit rendu accessible au public comme choix de traitement pour tous les patients atteints d'HTAP au Canada afin de permettre les meilleurs résultats possibles pour ceux qui vivent avec cette maladie.
Si vous souhaitez parler à votre représentant élu provincial de l'importance de l'accès aux traitements de l'HTAP, veuillez cliquer ici pour nous contacter dès aujourd'hui.
Cliquez ici pour télécharger une copie de l'exposé (en anglais) de position de l'AHTP Canada soulignant l'importance de l'accès à tous les traitements approuvés par Santé Canada pour l'HTAP, ainsi que les avantages démontrés d'Opsumit par rapport aux autres ARE par voie orale approuvés.
Uptravi® (selexipag)
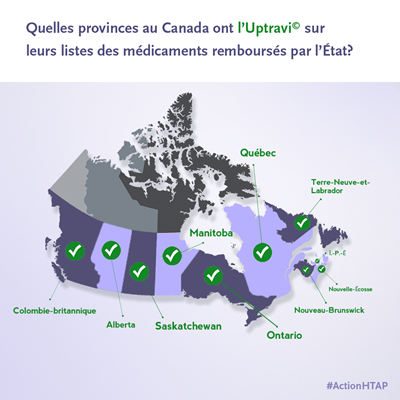
Approbation:
En janvier 2016, Santé Canada a approuvé la commercialisation d’Uptravi au Canada pour le traitement de l’HTAP. Uptravi, le premier agoniste du récepteur IP administré par voie orale, est approuvé pour le traitement prolongé de l’HTAP idiopathique (sans cause connue), de l’HTAP héréditaire, de l’HTAP associée à des troubles du tissu conjonctif et de l’HTAP associée à une cardiopathie congénitale, afin de retarder l’évolution de la maladie chez les patients adultes de classe fonctionnelle II ou III.
Financement public:
En octobre 2016, le Programme commun d’évaluation des médicaments (PCEM) recommandait le financement public d’Uptravi dans le reste du Canada pour le traitement prolongé de l’HTAP chez les patients dont la maladie n’est pas maîtrisée de façon adéquate au moyen d’un traitement de première ou de deuxième intention, avec toutefois une diminution importante du coût. En décembre 2017, l’Alliance pancanadienne pharmaceutique (APP) a pu négocier une entente sur le prix d’Uptravi.
À ce jour, Uptravi est accessible via le financement public dans chaque province canadienne.
Adempas® (riociguat)
Approbation:
En mars 2014, Santé Canada a approuvé la commercialisation d’Adempas pour le traitement de l’HTAP. Adempas, un stimulateur de la guanylate cyclase soluble (GCs), est également le seul traitement médicamenteux approuvé contre l’hypertension pulmonaire thromboembolique chronique (HPTEC).
Financement public:
En décembre 2015, le Programme commun d’évaluation des médicaments (PCEM) a recommandé le financement public d’Adempas (selon certains critères et une condition) pour le traitement, en monothérapie ou en association avec des antagonistes des récepteurs de l’endothéline (ARE), des patients adultes atteints d’HTAP de classe fonctionnelle II ou III. En février 2015, le Québec a décidé de ne pas inscrire Adempas sur la liste des médicaments contre l’HTAP remboursés par son régime public d’assurance médicaments, tandis que la Saskatchewan a pris la même décision en septembre 2016. En janvier 2017, faute d’une entente, on annonçait la suspension des négociations avec l’Alliance pancanadienne pharmaceutique (APP) en vue d’établir le coût d’Adempas pour le traitement de l’HTAP, de sorte que les patients d’un bout à l’autre du pays ne peuvent avoir accès au médicament par l’entremise des régimes publics d’assurance médicaments.
Le point sur les activités de défense des droits:
Les communautés de l’HTAP et de la sclérodermie continuent d’exhorter les gouvernements à rembourser Adempas pour le traitement de l’HTAP par l’intermédiaire des régimes publics d’assurance médicaments.
Veuillez cliquer ici pour obtenir des détails sur les activités de défense des droits ainsi qu’une rétrospective des événements liés au financement public des traitements approuvés.
Veuillez cliquer ici pour obtenir plus d’information sur le processus d’homologation et de remboursement des médicaments au Canada.